商机详情 -
安徽推荐的药物安全性评价价格
药物安全性评价研究的目的是通过毒理学试验对受试物的毒性反应进行暴露,在非临床试验中提示受试物的临床安全性。可通过不同的毒理学试验,根据受试物给药的剂量/暴露的程度、给药途径、给药周期、出现的毒性反应症状及性质、病理学检查发现的靶***以及毒性反应、毒性损伤是否可逆等,对毒性反应进行定性和/或定量暴露,推算临床研究的安全参考剂量和安全范围,从而预测临床用药时可能出现的人体毒性,以制定临床监测指标、防治措施。并综合考虑拟用的适应症、用药人群等特点等进行利弊权衡,判断是否应进入相应的临床研究。药物安全性评价在哪做比较好?安徽推荐的药物安全性评价价格
一直认为,安全性和有效性是药物的基本标准,对食品和食品补充剂也应该采用类似标准,至少在成分分析和科学研究支持方面,需要提供基本的证据,可以不需要大规模双盲对照的临床研究数据,至少要有初步的临床研究结果,尤其是药物安全性评价的评价指标。**起码,哪怕是没有效果,也不要存在毒性。食品补充剂不像药物那样,在投放市场前必须提供安全性和有效性的证据,法律上也没有批准FDA授权的食品补充剂。FDA只有对上市的食品补充剂发现存在不安全问题时才发挥监管作用。甘肃专注药物安全性评价实验药物安全性评价主要数据指标有哪些?
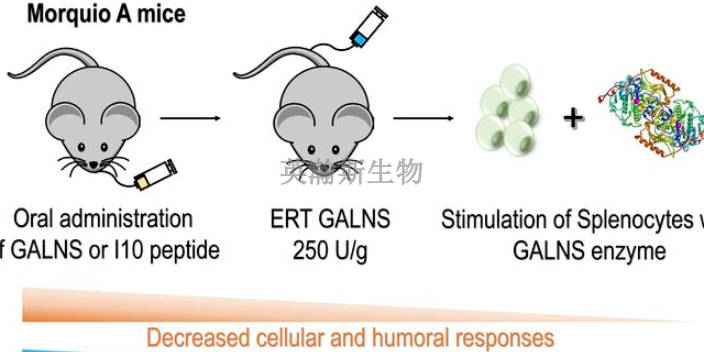
为客观评价药物的安全性,应***理解实验室检查结果变化的统计学意义与临床意义的关系,有统计学意义的检查结果改变不一定有临床意义,这要结合相关参数临床上的参考值范围和统计学意义产生的原因来综合考虑;而没有出现统计学意义并不一定意味着没有临床意义,应注意变化趋势的明显程度并结合所在实验室参考值范围等来综合考虑,对个体结果进行定性分析并计算群体异常率,常常可以发现其变化的统计学和临床意义。在此基础上综合判定与分析毒性与药物的相关性。为此,建议结合下述因素进行综合分析:①剂量效应关系;②与给药前结果、同期对照组的比较;③受试动物历史对照信息、流行病学的背景资料和动物饲养条件;④其他毒理学研究和评价的结果;⑤动物药代/毒代动力学研究结果;⑥靶***毒性相关指标系统的综合分析;⑦脏器组织病理学检查及量化的结果。由此对毒性靶***、毒性反应及安全范围进行综合判断。
特殊安全性试验包含:过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、黏膜、肌肉等)刺激性等主要与局部、全身给药相关的特殊安全性试验;复方制剂中多种成分毒性相互影响的试验;致突变试验;生殖毒性试验;致*试验;依赖性试验。药物安全性评价主要数据指标包含以下几类:比较大耐受剂量(MTD)是指在急性毒性试验中,受试物不引起受试对象(实验动物)出现死亡的比较大剂量。比较大无毒性反应剂量(NOAEL),指药物在一定时间内,按一定方式与机体接触,按一定的检测方法或观察指标,不能观察到任何损害作用的比较高剂量。**小致死剂量(MLD),引起个别动物死亡的**小剂量。英瀚斯成熟团队拥有丰富新药项目临床药物安全性评价的经验。
药物安全性评价把握药理毒理学研究的整体性:新药非临床安全性研究是新药研发系统中的一个有机整体。不能把某一个毒理研究与其他毒理研究和药理学、药代动力学研究割裂开来,试验设计时应充分考虑其它药理毒理研究的研究结果。例如,为了使一个较长期重复给药的毒理试验得以成功,往往需要参考急性毒性、一般药理和药代动力学研究和短期重复给药试验结果等来对其进行合理设计;在评价方面,毒性研究的结果应该力求与其它药理毒理试验结果互为印证、说明和补充。例如,长毒试验中性***的相关检查可以一定程度上反映受试物对动物生殖功能的影响。一般药理试验中观察到的不良反应可以与长毒试验和急毒试验的相互印证。目前国内普遍存在研究总体设计和实施的整体差的问题,直接影响了非临床安全性评价的质量。为了解决这个问题,需要研究者,尤其是课题负责人加强对非临床安全性研究整体性的认识,并在具体实施过程中进行总体把握。药物安全性评价是新药品进入临床试验和批准前的必要程序和重要步骤。甘肃专注药物安全性评价实验
药物安全性评价要求药物的基本要求、安全、有效、质量可控 。安徽推荐的药物安全性评价价格
从新药研发流程来看,有的被药监部门批准上市到真正上市还有一定距离。据统计,大约有10%~20%批准上市的新药,由于质量、生产工艺、安全有效和商业等原因并未上市。临床IV期(药品上市后的**研究)的药物还是处在临床研究中的新药,药品上市后在广大人群中应用的有效率、长期效应、剂量和疗程、新的适应征以及影响药品疗效的因素(治疗方案、患者年龄、生理状况等)都是上市前研究尚未解决的。近年来,大量新批准的药品上市,伴随着可能出现的安全性问题,临床IV期药品上市后的药物安全性评价**研究得到了药企和医院等机构的重视,从临床疗效的研究逐步改变新药的临床地位和生命周期,也就是药物上市后临床才显现新药的真实世界。安徽推荐的药物安全性评价价格