商机详情 -
深圳MII期纺锤体揭示卵母细胞关键结构
在有丝分裂中,纺锤体的形成与功能至关重要。首先,在有丝分裂前期,中心体复制并分离至细胞两极,形成纺锤体的两极。随后,微管从两极向中心区域延伸,形成纺锤体的主干。在中期,染色体在纺锤丝的牵引下,自动在赤道板排列整齐。当细胞进入分裂后期,纺锤体微管收缩,将染色体牵引至两极,形成两组数目相等的姐妹染色单体。这一过程确保了遗传信息的准确传递,避免了染色体分离错误导致的遗传异常。此外,纺锤体还决定了胞质分裂的分裂面。在染色体分裂的同时,纺锤体中的一部分微管不随染色体分裂到两极,而是停弛在纺锤体中心,形成纺锤中心体。纺锤中心体的中心区域为两组极性相反的微管交叠区,称为纺锤中心区,它决定了接下来的胞质分裂面。胞质分裂开始于分裂后期的较晚期,一般结束于分裂末期后1-2小时,此期间两个子细胞由中心颗粒体连接。纺锤体通过精确控制胞质分裂面的位置,确保了细胞分裂的对称性和稳定性。 纺锤体的功能异常与某些药物的副作用有关,如化疗药物可能干扰纺锤体的形成和功能。深圳MII期纺锤体揭示卵母细胞关键结构
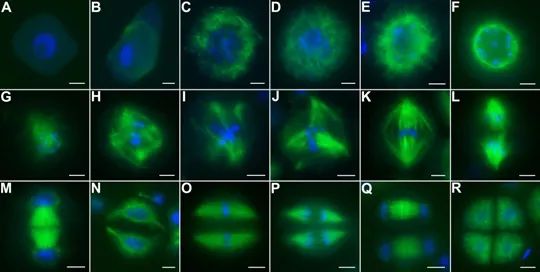
纺锤体是如何形成的(2)动粒微管连接染色体动粒与位于两极的中心体。在有丝分裂前期,一旦核被膜解聚,由相反两个方向的中心体伸出的动粒微管就会随机地与染色体上的动粒结合而俘获染色体,微管**终附着在动粒上,动粒微管把染色体和纺锤体连接在一起。在细胞分裂期的后期,分开后的染色单体被拉向两极。染色体移动由两个相互独立且同步进行的过程所介导,分别为过程A和过程B。在过程A中,在连接微管和动粒的马达蛋白的作用下,动粒微管解聚缩短,在动粒处产生的拉力使染色体移向两极。极间微管是从一个中心体伸出的某些微管与从另一个中心体伸出的微管相互作用,阻止了它们的解聚,从而使微管结构相对稳定,两套微管的这种结合形成了有丝分裂纺锤体的基本框架,具有典型的两极形态,产生这些微管的两个中心体称为纺锤极,这些相互作用的微管被称为极间微管。在有丝分裂后期过程B中,极间微管的伸长和相互间的滑行使纺锤极向两极方向移动。星体微管从中心体向周围呈辐射状分布,在有丝分裂后期过程B中,每一纺锤极上向外伸展的星体微管发出向外的力,拉动两个纺锤极向两极方向移动。深圳双折射性纺锤体纺锤体结构纺锤体微管的动态不稳定性是其功能的基础。
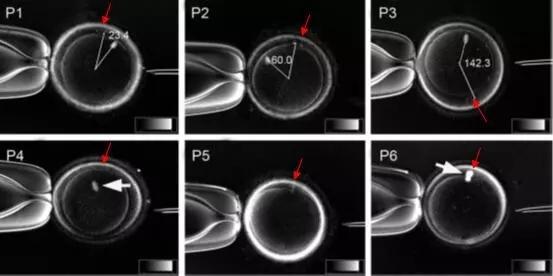
在纺锤体卵冷冻过程中,利用纺锤体实时成像技术可以实时监测纺锤体的变化。通过观察冷冻过程中纺锤体的形态、位置及动态变化,研究者可以判断冷冻保护剂的效果、冷冻速率等因素对纺锤体的影响,从而优化冷冻方案,减少纺锤体损伤。解冻后,利用纺锤体实时成像技术可以对卵母细胞内的纺锤体进行再次评估。通过比较解冻前后纺锤体的形态和稳定性,研究者可以判断冷冻过程对纺锤体的损伤程度,并筛选出纺锤体形态完好的卵母细胞进行后续操作,提高受精率和胚胎发育质量。
尽管纺锤体成像技术已经取得了明显的进展,但仍存在一些挑战和限制。例如,目前的高分辨率成像技术往往需要对样品进行特殊处理或标记,这可能会对细胞的活性和功能产生影响。此外,成像速度和分辨率之间仍存在权衡关系,如何在保持高分辨率的同时提高成像速度是当前研究的重点之一。未来,随着成像技术的不断创新和进步,纺锤体成像技术有望实现更高的分辨率、更快的成像速度和更好的细胞活性保持能力。例如,基于量子点的荧光标记技术、基于人工智能的图像重建算法以及基于超快激光的成像技术等都有望为纺锤体成像技术的发展带来新的突破。此外,结合其他细胞生物学技术,如基因编辑、蛋白质组学等,纺锤体成像技术将能够更深入地揭示细胞分裂的复杂机制和纺锤体的功能作用。 纺锤体微管的排列方向决定了染色体分离的方向。
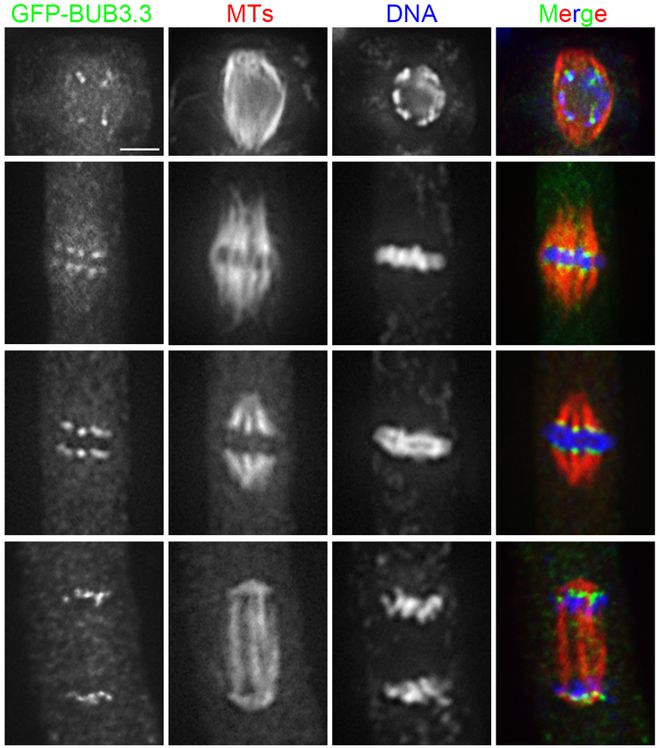
微管蛋白的突变会影响微管的聚合和解聚,导致纺锤体结构异常。例如,某些疾病中,微管蛋白的突变会导致纺锤体功能障碍,增加染色体非整倍性的风险。动粒与微管结合能力下降:动粒是染色体与纺锤体微管连接的关键结构,其功能障碍会影响染色体的正确捕捉和分离。例如,某些基因突变(如BUBR1突变)会影响动粒的功能,导致染色体分离错误。动粒通过信号传导途径与纺锤体检查点相互作用,确保染色体的正确分离。动粒信号传导异常会导致纺锤体检查点失效,增加染色体非整倍性的风险。 纺锤体是细胞分裂过程中形成的复杂细胞器,主要由微管和中心体构成。深圳MII期纺锤体起偏器
纺锤体由微管组成,其动态变化调控着细胞分裂的进程。深圳MII期纺锤体揭示卵母细胞关键结构
哺乳动物卵母细胞的纺锤体由微管组成,这些微管结构精细且高度动态,对温度、渗透压和机械力等外界因素极为敏感。在冷冻过程中,纺锤体容易因冰晶形成、渗透压变化或机械损伤而遭到破坏,导致染色体分离异常,进而影响卵母细胞的发育潜力和受精后的胚胎质量。选择合适的冷冻保护剂是减少纺锤体损伤的关键。然而,不同浓度的冷冻保护剂对纺锤体的影响各异,且不同哺乳动物种类之间也存在差异。因此,需要通过大量实验来优化冷冻保护剂的配方,以大限度地保护纺锤体的完整性。深圳MII期纺锤体揭示卵母细胞关键结构