商机详情 -
云南创新药物临床前安全性评价服务
特殊毒性研究针对药物可能引发的特定organ或系统毒性。心脏毒性评估通过hERG通道抑制实验(体外)和犬/猴心电图监测(体内),明确药物是否可能引发QT间期延长或前列扭转型室速。例如,某antibiotic因hERG抑制实验阳性,被FDA要求补充心脏安全药理学研究,终调整剂量方案以降低风险。免疫毒性研究通过淋巴细胞亚群分析、细胞因子检测及自身抗体测定,评估药物是否可能引发过敏反应或自身免疫病。以生物制剂为例,在食蟹猴免疫毒性实验中,发现其可诱导抗药物抗体(ADA)产生,导致药效丧失,需优化制剂工艺以降低免疫原性。此外,光毒性研究(如UV-A照射下皮肤红斑反应)对皮肤科药物尤为重要,需在临床前明确其光安全阈值。环特生物开展基因编辑研究,赋能临床前实验创新升级、。云南创新药物临床前安全性评价服务
外泌体作为纳米级细胞外囊泡,尺寸在30-150纳米,由几乎所有细胞分泌,在细胞间信号传递中扮演关键角色。临床前研究首要聚焦于外泌体的基础特性,包括其生物合成、分泌机制以及内含物组成。研究发现,外泌体富含蛋白质、核酸和脂质等生物活性成分,且其内容物反映了来源细胞的状态。例如,肿瘤细胞分泌的外泌体与正常细胞来源的相比,其蛋白质和核酸谱存在明显差异,这些差异为疾病诊断提供潜在生物标志物。同时,深入了解外泌体如何被细胞摄取、释放及在体内循环,有助于揭示其发挥生理病理作用的机制,为后续临床应用奠定理论基石。药物试验临床前实验环特生物深耕临床前实验,为药物研发筑牢早期研究基础.

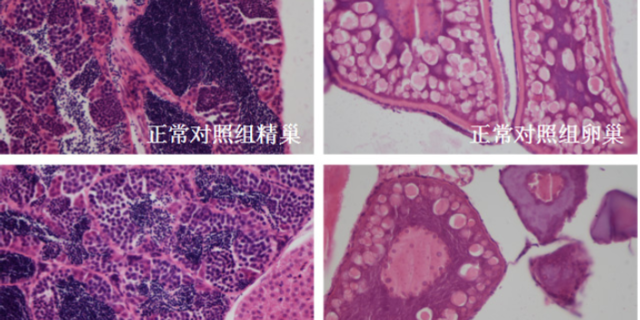
新药临床前毒理学试验涵盖多种类型和方法。急性毒性试验是其中较为基础的一种,它通过给予动物单次或24小时内多次较大剂量的受试药物,观察动物在短期内出现的毒性反应,如中毒症状、死亡情况等,以此来初步确定药物的致死剂量范围和毒性靶organ。长期毒性试验则更为深入,通常会持续较长时间,按照拟定的临床给药的方案,分不同剂量组给予动物药物,密切监测动物在整个试验期间的体重变化、血液学指标、血液生化指标、组织病理学改变等,多方面评估药物长期使用对机体各系统功能和结构的影响。此外,还有特殊毒性试验,包括遗传毒性试验,检测药物是否会引起基因突变、染色体畸变等遗传物质的改变;生殖毒性试验,研究药物对生殖过程、胚胎发育、子代的生长发育等方面的作用;以及致ancer性试验,判断药物是否具有潜在的致ancer风险。这些不同类型的试验相互配合,从多个角度为新药的安全性评价提供丰富且准确的数据。
毒理学研究是临床前研究的“安全阀”,需通过急性毒性(单次高剂量给药)、重复给药毒性(28天/90天多次给药)、遗传毒性(Ames试验、小鼠淋巴瘤试验)及生殖毒性(胚胎致死性、致畸性)实验,多方面评估分子的安全性。例如,针对抗凝血药物,需通过大鼠尾静脉出血时间实验确定耐受剂量(MTD),避免引发过度出血风险;针对抗tumor药物,则需关注骨髓抑制(通过血常规检测白细胞、血小板计数)及肝毒性(通过ALT/AST酶活性测定)。特殊毒性研究(如光毒性、心脏毒性)也不可忽视——例如,通过hERG通道抑制实验评估药物是否可能引发QT间期延长。毒理学数据的解读需结合医疗窗(有效剂量与毒性剂量的比值),若候选分子的医疗指数(TI)>5,则认为安全性可控;若TI<3,则需重新优化结构或调整给药的方案。临床前实验缩短研发周期,环特生物提供高效技术方案。
体外药效评估是临床前研究的起点,通过高灵敏度技术(如荧光标记、流式细胞术)量化候选药物对靶点的直接作用。针对激酶抑制剂,常用酶联免疫吸附试验(ELISA)或表面等离子共振(SPR)测定其对靶酶的抑制活性(如IC50、Ki值);针对抗体药物,则通过流式细胞术检测其与抗原的结合亲和力(KD值)。细胞水平实验进一步验证药物对疾病相关细胞的功能影响,例如:抗tumor药物需在多种ancer细胞系(如A549肺ancer细胞、MCF-7乳腺ancer细胞)中测试增殖抑制率(通过MTT法或Brdu掺入法);抑炎药物需在巨噬细胞中检测炎症因子(如TNF-α、IL-6)的分泌抑制效果。此外,3D细胞模型(如tumor球体、类organ)可模拟体内微环境,更真实地反映药物穿透性及细胞间相互作用。例如,某EGFR抑制剂在2D细胞实验中IC50为10nM,但在3Dtumor球体中需50nM才达同等效果,提示需优化结构以提升穿透性。临床前实验降低研发风险,环特生物定制化设计实验方案。宁波毒理实验临床前新药评价中心项目
扎实的临床前数据,是新药进入临床试验阶段的重要依据。云南创新药物临床前安全性评价服务
v类organ(Organoids)和器官芯片(Organ-on-a-Chip)技术是临床前药效研究的改变性工具,可模拟人体organ的复杂结构与功能。类organ由患者来源的干细胞或成体细胞在体外自组装形成,保留了原始组织的细胞类型、空间排列及部分生理功能。例如,结直肠ancer类organ可保留患者tumor的突变特征(如KRAS、APC突变),用于测试靶向药物的敏感性;肝类organ可模拟药物代谢过程,预测肝毒性。器官芯片则通过微流控技术将多种细胞类型(如内皮细胞、免疫细胞)共培养于芯片上,构建动态生理环境。例如,肺芯片可模拟呼吸运动及气流对药物分布的影响,用于评估吸入制剂的疗效。此类技术相比传统动物模型更具人源化特征,可减少种属差异导致的假阴性/阳性结果。例如,某抗纤维化药物在动物模型中无效,但在肺类organ中明显抑制成纤维细胞活化,终通过类organ数据支持其进入临床试验。云南创新药物临床前安全性评价服务